Equilibrio térmico, temperatura e intercambio de energía interna.
La materia está en uno de los tres estados: sólido, líquido o gas: En los sólidos, las posiciones relativas (distancia y orientación) de los átomos o moléculas son fijas. En los líquidos, las distancias entre las moléculas son fijas, pero su orientación relativa cambia continuamente. En los gases, las distancias entre moléculas, son en general, mucho más grandes que las dimensiones de las mismas. Las fuerzas entre las moléculas son muy débiles y se manifiestan principalmente en el momento en el que chocan. Por esta razón, los gases son más fáciles de describir que los sólidos y que los líquidos.
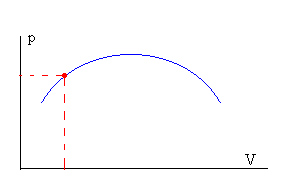 Denominamos estado de equilibrio de un sistema cuando las variables macroscópicas presión p, volumen V, y temperatura T, no cambian. El estado de equilibrio es dinámico en el sentido de que los constituyentes del sistema se mueven continuamente.
Denominamos estado de equilibrio de un sistema cuando las variables macroscópicas presión p, volumen V, y temperatura T, no cambian. El estado de equilibrio es dinámico en el sentido de que los constituyentes del sistema se mueven continuamente.El estado del sistema se representa por un punto en un diagrama p-V. Podemos llevar al sistema desde un estado inicial a otro final a través de una sucesión de estados de equilibrio.
trabajo mecánico hecho por o sobre el sistema.
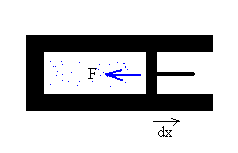 | Consideremos, por ejemplo, un gas dentro de un cilindro. Las moléculas del gas chocan contra las paredes cambiando la dirección de su velocidad, o de su momento lineal. El efecto del gran número de colisiones que tienen lugar en la unidad de tiempo, se puede representar por una fuerza F que actúa sobre toda la superficie de la pared. | http://www.sc.ehu.es/sbweb/fisica/estadistica/termo/Termo.html |
No hay comentarios:
Publicar un comentario